锂离子电池充放电机理及“锂亚原子”模型
摘要:锂离子电池的研讨和开展一直都是以“摇椅理论”为辅导,因为受该理论的影响,许多现象很难用传统的电化学理论进行解说。作者在出产实践中通过对一些现象的调查,并做了很多的实验和研讨,提出“锂亚原子”的模型,并在此模型的基础上,对锂离子电池的充放电反响机理和一些现象用电化学理论进行了解说。
主题词:锂离子电池、反响机理、锂亚原子
一、前语
锂离子电池是在锂金属电池基础上开展起来的。因为锂金属电池在充放电时呈现锂枝晶,刺破隔阂构成短路,呈现爆破等现象,这一问题长时刻困扰锂金属电池的开展,现在仍很难投入到民用商场。锂离子电池研讨始于20世纪80年代,1991年首先由日本索尼公司推出了批量民用产品,因为其具有比能量高、体积小、重量轻、作业电压高、无回忆效应、无污染、自放电小等长处,遭到商场欢迎,并敏捷占领商场,广泛用于移动通讯、笔记本电脑、移动DVD、摄像机、数码相机、蓝牙耳机等便携式电子产品。现在首要产地会集在日本、我国和韩国,估计2004年全球需求量将抵达10亿只。
因为锂离子电池从开端研讨到现在才20多年时刻,真实投入使用也只要十多年的时刻,基础理论的研讨还不是十分老练,对锂离子电池的出产和开展很难起到全面辅导效果,特别是对电池充放电反响机理的知道还存在很大不合,有些现象用现在的理论和机理还很难解说。本文对锂离子电池充放电反响机理提出了一些观念,并对出产中存在的现象进行了解说,期望与锂电池同行一起讨论。
二、根本原理
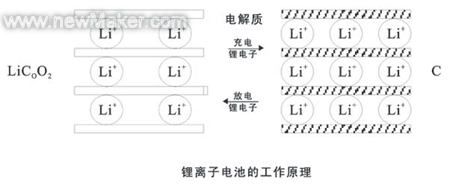
现在锂离子电池公认的根本原理为“摇椅理论”,该理论以为锂离子电池充放电反响机理不是通过传统氧化复原反响来完成电子搬运,而是通过锂离子在层状物质的晶格中嵌入和脱出,发作能量改变。
现在锂离子电池正极一般选用LiCOO2,负极为石墨,电解液为LiPF6+EC+DMC。充电时锂离子从正极层状氧化物的晶格间脱出,通过有机电解液迁移到层状负极外表后嵌入到石墨资料晶格中,一起剩下电子从外电路抵达负极。放电则相反,锂离子从石墨晶格中脱出回到正极氧化物晶格中。在正常充放电情况下,锂离子在层状结构的石墨和氧化物间的嵌入和脱出一般只引起层间隔的改变 ,而不会引起晶体结构的损坏,随同充放电进行,正负极资料的化学结构根本不发作改变,因而从充放电反响的可逆性来讲,锂离子电池是一种抱负的可逆电池。锂离子进入电极进程叫嵌入,从电极中出来的进程叫脱出,在充放电时锂离子在电池正负极中往复的嵌入——— 脱出,正像摇椅子相同在正负极中摇来摇去,故有人将锂离子电池形象的称为“摇椅电池”。
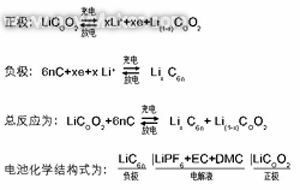
充放电时正负极发作反响为:
三、锂离子电池存在的现象及疑问
(一)荷电态的石墨负极在空气中自燃
将锂离子电池在荷电状况下进行解剖,取出正负极片放在空气中调查,通过几分钟(荷电量多,时刻短;荷电量少,时刻长)发现负极外表呈现白色物质,并伴有气泡发作,极片有发热现象,随后气泡逐步加重,严峻时呈现焚烧。
(二)钴酸锂在空气中长时刻寄存发作蜕变
正极资料钴酸锂放在NMP和PVDF中拌和均匀后寄存15天,发现钴酸锂变成“豆腐脑状”。假如放在水中拌和均匀寄存,几天时刻即呈现此现象。用“蜕变”的钴酸锂制造电池容量很低。
依据摇椅理论,锂在正负极中是以离子状况存在的,应该是十分安稳的,COO2和石墨自身也是十分安稳的物质,很难同空气中的物质发作反响。剖析以上两种现象很像是锂同水发作了反响,假如是锂,它又是从何而来,假如锂不是以离子形状在正负极资猜中存在,那它又为什么相对安稳呢?看来很难用摇椅理论来解说此现象。为了解说上述现象,本文提出一些新的“观念”,并据此揣度锂离子电池充放电反响机理,解说一些锂离子电池存在的现象,供锂电池同行参阅。
四、“锂亚原子”形状的存在和充放电反响机 理“假说”
锂在锂离子电池的正负极资猜中存在形状不是离子形状,但又不是原子形状,而是介于原子与离子的中心形状,暂定为“锂亚原子”,锂原子核和电子构成一对类似于共价化合物的安稳的化学键,既具有锂离子安稳性,又具有必定的锂原子活性。在没有外界条件激活时是比较安稳的,表现出锂离子功能,一但遇到适宜的条件,又能够发作反响,表现出锂原子的功能。“锂亚原子”的活性同电子与原子核间隔有关,间隔越远,安稳性越好。而锂的电子与原子核间隔是由其存在资料特点决议的,COO2和石墨能对锂原子发作激烈效果,使其电子远离原子核构成“锂亚原子”。COO2对锂原子效果比石墨更强,电子与原子核间隔更远,因而COO2中的“锂亚原子”比石墨中的“锂亚原子”更安稳。
依据这种假定揣度,锂离子电池在充放电进程中应该是“锂亚原子”发作氧化复原反响,而不是锂离子嵌入—— 脱出。
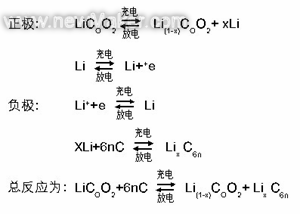
充电时,“锂亚原子”失掉电子变成离子后进入溶液,锂离子在电场效果下抵达负极,与从外电路过来的电子在石墨的效果下构成“锂亚原子”,存在于负极资猜中。放电则相反,“锂亚原子”失掉电子变成锂离子进入溶液,在电场效果下迁移到正极,与外电路过来的电子在COO2效果下构成“锂亚原子”存在于正极资猜中。充放电时正负极能量改变是由“锂亚原子”得失电子构成的,即在正负极上发作氧化复原反响,仅仅在南北极发作反响为同一种物质。层状物质COO2和石墨(6n个C)能对锂原子发作激烈效果,使电子远离原子核,构成相对安稳类似于共价键化合物的物质LiCOO2和LiC6n。因而,LiCOO2不能叫为钴酸锂,应该叫“锂钴氧化物”更适宜,“锂离子电池”称号也不适宜,应该叫“锂蓄电池”。
五、剖析与讨论
(一)荷电态负极片在空气中自燃现象解说
在充电时,石墨的6n个碳原子对锂原子发作了激烈效果,构成具有安稳化学键的LixC6n化合物,其间Li是以亚原子形状存在,相对比较安稳,因而电池刚解剖时极片没什么反响,因为锂不是离子态,并且碳对其引力也不是很强壮,因而仍具有必定活性,能够与空气中水发作反响:
Li+H2O ===== LiOH+H2↑
此反响是放热反响,反响放出热量进一步激活“锂亚原子”,使其具有更高活性,反响进一步加重,因而寄存几分钟后会有气泡发作,并有白色LiOH发作。假如荷电量比较大,“锂亚原子”数量较多,反响量很大,就会发作自燃现象。假如存在Li与H2O反响,应生成强碱性LiOH。用PH纸测验白色物质是为强碱性,而LiPF6电解液为弱酸性,这也进一步证明了LiOH存在。
(二)钴酸锂在空气中长时刻寄存发作蜕变的解说
锂因为遭到氧化钴激烈效果构成“锂亚原子”,氧化钴比石墨对锂的效果更大,因而,锂的电子间隔锂原子核更远,更挨近于离子态。因而,它是比较安稳,但它究竟不是离子,还具有必定的活性,长时刻寄存时NMP逐步吸收空气中水份与“锂亚原子”缓慢发作反响,逐步发作改变并放出必定热量,豆腐脑状物质便是钴酸锂失掉部分锂后和反响生成LiOH的混合物。在水溶液中因为水份充沛,反响比在NMP中快。由此引出纯钴酸锂长时刻在空气中寄存也会有部分锂丢失,为验证此说法,将钴酸锂在空气中寄存1个月后再配料制造电池比容量比正常低5%左右。
(三)锂离子电池过流充电会发作爆破
锂离子电池充电5倍率以上简单发作爆破,这首要是锂与石墨中6n个碳构成LiC6n化合物的反响是有必定反响速度的。在小电流充电时,Li++e→Li反响速度比Li+6nC→LiC6n结合速度慢,不会构成锂原子堆积,因而比较安全。在过流(5C以上)时构成锂原子速度会比构成LiC6n速度快,因而会构成锂原子堆积,构成锂枝晶,刺穿隔阂,致使电池内阻短路,电池短路会使放电电流瞬间添加很大,放出很多热量,使电解液分化发作很多气体,内压急剧上升构成电池爆破。
(四)锂离子电池过热(150℃以上)会发作爆破
因为锂在氧化钴和石墨中是以亚原子状况存在,在受热条件下其活性大大添加,在超越150℃以上时氧化钴和石墨对锂效果大大削弱,锂的电子与锂原子核间隔很近,根本挨近或抵达锂原子状况,锂原子与电解液能发作反响,发作很多气体,内压敏捷上升,构成电池爆破。
六、定论
(一)氧化钴和石墨等层状物质能对锂原子发作激烈效果,使其变成介于原子和离子状况之间的形状——— 亚原子,锂在氧化钴和石墨中是以亚原子形状存在的,而不是以离子形状存在。
(二)“锂亚原子”的活性同锂原子核与电子之间隔离有关,间隔越近,活性越高,锂的电子与原子核的间隔是由其存在资料特点决议的。
(三)锂离子电池充放电机理也是氧化复原反响,仅仅正负极参与反响为同一种物质。
(四)钴酸锂应该叫“锂钴氧化物”,锂离子电池应该叫“锂蓄电池”。 (end)