直接硼氢化钠/双氧水燃料电池研讨
摘要:选用Pt/C作为催化剂成功地拼装了直接硼氢化钠/双氧水燃料电池,并调查了不同操作温度、溶液流速和浓度 条件下电池的放电功能。 60℃时电池的最大比功率能够到达130 mW/cm2,在40℃时0.1 A/cm2放电条件下电池电 压约为0.7 V,功能显着优于相同条件下直接甲醇燃料电池。一起研讨了不同厚度电解质膜对电池功能的影响,选用 Nafion117膜(厚度175 mm)的电池开路电压比Nafion112(厚度 50 mm)高约180 mV,但Nafion112在高电流密度 放电时体现出了更好的功能。因而,膜厚度不只影响电池的内阻而且还会影响反响物的彼此浸透。此外,还测验了短时 间恒电流放电,电池功能未呈现下降,而且放电后催化层和膜依然坚持紧密结合。
运用氢气的质子交流膜燃料电池近些年来取得了广泛的 重视,尤其是在电动汽车等大型牵引动力源方面研讨取得了 许多发展。但因为氢气贮存困难,便携性差等缺乏约束了其在 小型可移动电源方面的运用,人们一向企图寻觅替代氢气的 液体燃料,其间以甲醇作为燃料的直接甲醇燃料电池(DM- FC)被以为在此范畴大有作为。但是甲醇氧化速度慢,甲醇渗 透等问题一向没有彻底处理,使得DMFC商业化过程中遇到了许多阻力[1]。 硼氢化物相同作为一种液体燃料,具有便于贮存、运送等 特色,更为重要的是它的活性要远高于醇类燃料,而且假如采 用双氧水作为氧化剂,整个反响将不依靠空气,有望在一些特 殊范畴例如水下和航天方面的便携式电源取得运用[2-4]。 硼氢化钠作为反响燃料的反响方程式如下[5-6]:
通过理论核算能够得出硼氢化钠燃料电池的开路电压和 比能量别离为1.64 V和9 295 Wh/kg比甲醇的开路电压和比 能量别离高0.4 V和 3 200 Wh/kg[6]。
关于阴极用氧气作为燃料的硼氢化钠燃料电池,依然存 在与甲醇燃料电池相同的阴极气体贮存带着不方便的问题,为 此,研讨者提出了以H2O2替代O2的 NaBH4/H2O2燃料电 池[7-8]。假如阴极H2O2为碱性,则阴极反响为:
近几年来,许多研讨者在催化剂资料挑选方面作了很多 的研讨。为了处理阳极催化剂活性低的问题,Gyenge等人提 出了胶体Os、Au、Pt和Os、 Au、Pt基的合金催化剂,试验发 现,Pt-Ni和Pt-Ir合金催化剂有最好的活性[9-11];Chatenet等人 研讨了Au和Ag块材和纳米颗粒涣散在碳载体的催化剂,实 验发现纳米涣散在碳上的Au催化剂具有最好的活性[12]; Feng等人运用MnO2作为阴极催化剂发现既有较好的氧复原 活性又能够削减硼氢化钠浸透所导致的阴极极化[13]。此外,针 对硼氢化钠的浸透,研讨人员又从膜和催化剂两方面进行了 研讨,Lakeman测验了十二种不同的质子交流膜[14],Shukla等 人报导了运用Nafion961膜制造的电池在削减硼氢化钠浸透 方面比传统的运用 Nafion117有了较大的进步[15];但是,体系 研讨操作条件对硼氢化钠/双氧水电池功能影响的文章较 少。
本文通过单电池点评设备测验了NaBH4/H2O2燃料电池 的极化曲线,体系研讨了不同作业温度、浓度、流速对电池性 能的影响,而且比较了不同厚度 Nafion膜对电池功能的影 响。一起调查了电池的短期运转稳定性。
1试验内容
1.1 Nafion膜
Nafion膜在运用前进行预处理,以去除膜中的有机物和 金属离子。详细做法如下:将必定尺度的Nafion膜顺次在3% (质量分数)的H2O2、去离子水、0.5 mol/L的H2SO4、去离子水 中处理,每次处理时刻为1 h,处理温度为80℃。处理后的 Nafion膜保存在去离子水中备用。
1.2电极的制备
催化剂选用Johnson Matthey公司的40%的Pt/C。详细的 制备工艺如下:取少数Pt/C催化剂放入乙醇中超声涣散成 “油墨”状,然后滴加Nafion溶液,其间催化剂与Nafion干重 质量比为9︰1,超声后均匀涂在分散层碳纸上即得到电极。 试验中Pt载量为 1.4 mg/cm2。试验所用的阴极与阳极电极均 为相同的Pt/C电极,电极活性面积2.5 cm×2.5 cm。
1.3膜电极三合一的制备
将阳极和阴极催化剂刷涂的一面朝向Nafion膜,在1.5 MPa,140℃下热压3 min,制成膜电极三合一(MEA)。
1.4溶液的制造
阳极硼氢化钠溶液选用NaBH4含量为10%,其间含有 5%NaOH,5%NH·3H2O;阴极双氧水选用H2O2含量为10%,其 中含有 5%H3PO4。关于不同浓度的NaBH4和H2O2其间各组 分的份额与上面的配比共同。
1.5电池功能的测验
将上述制好的膜电极三合一拼装单电池。集流板选用高 纯石墨制备,流场为单通道蛇形。两边用不锈钢板通过螺栓夹 紧,并置入NaBH4/H2O2燃料电池的点评设备中。
不同浓度的NaBH4和H2O2别离通过恒流泵以设定的流 速进入电池阳极和阴极,反响后的废液别离流进各自的废液 瓶,不再循环运用,以确保试验过程中反响物质的浓度坚持不 变。电池作业时通过热电偶和温度操控设备将其坚持在设定 的温度。电池的极化曲线丈量选用日本菊水电子的PLZ4电 子负载进行自动操控,在每个电流点进行恒电流放电,直到电 池电压不再发作显着的改动,再进行下一个点的丈量,停止电 压为0.2 V。
2结果与评论
2.1温度对直接硼氢化钠燃料电池功能的影响 图1是运用克己的电极和Nafion112膜拼装的电池在不 同温度下的作业功能曲线。其阳极NaBH4和阴极H2O2的浓 度均为10%,电池的阳极阴极流速别离为0.8 mL/min,3.2 mL/min。从图中能够看出,跟着温度的升高,电池的最大比功 率有较大的进步,开路电压也一起有所进步。在40℃时电池 的开路电压为1.39 V,最大比功率为74 mW/cm2;当温度升高 至60℃,开路电压和最大比功率别离升高至1.42 V和99 mW/cm2;持续升温到80℃会使电池开路电压比40℃时进步 了60 mV,最大比功率可达 117 mW/cm2。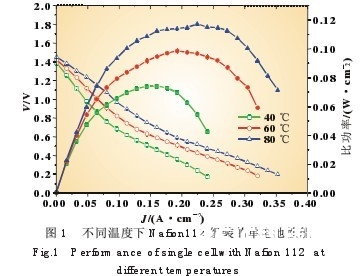
电池温度的升高,一方面添加了Nafion膜中Na+的传递 速度,下降了电池的全体内阻,然后进步电池放电才能;别的 一方面,温度的升高还将进步 NaBH4电化学氧化和H2O2电 化学复原反响速度,下降了反响的过电位,使得电池的开路电 压取得进步[16]。
2.2不同流速对单电池功能的影响
图2和图3别离是Nafion112膜拼装的电池在不同流速下的电池功能曲线,试验中的温度固定在60℃,阴极阳极液 体浓度均为10%。在图2中阳极流速固定在0.8 mL/min,能够 看出,跟着阴极流速的添加,电池的开路电压从阴极流速为2 mL/min时的1.41 V添加至5.2 mL /min时的1.43 V,电池最 大比功率相应的从83 mW/cm2进步到了93 mW/cm2。在图3 中阴极流速固定在3.2 mL/min,能够看出跟着阳极流速由 0.4mL/min升高至0.8 mL/min时,电池的最大比功率进步了 14 mW/cm2,开路电压升高了10 mV,但是当阳极流速升高至 1.6 mL/min时,电池的开路电压比0.4 mL/min时还削减了10 mV,电池的最大比功率比1.6 mL/min时削减了3 mW。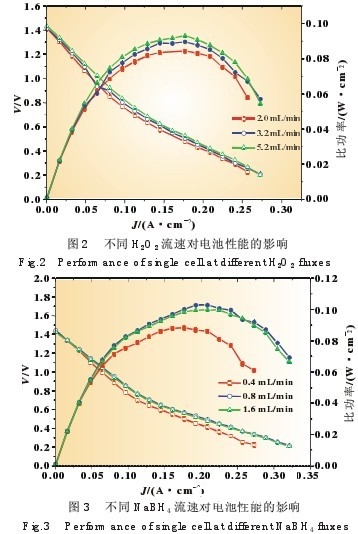
当阳极流速必守时,跟着阴极流速的添加,阴极传质速率 加速,流速的加速一起也会削减催化层孔洞的阻塞和产品的 堆集,然后使电池的功能进步[16];当阴极流速必守时,跟着阳 极流速添加,开端时电池的开路电压和最大功率会相应的增 加,但跟着流速的加大,功能则有所下降。这或许是因为高流 速下 NaBH4的浸透添加导致的阴极功能下降而形成的电池 功能全体下降。浸透到阴极的NaBH4会使阴极发作混合电位 然后下降了电池的开路电压。因而,在实践运用的时分,阳极 NaBH4的流速应该挑选在一个较佳的值。
2.3不同质料浓度对单电池功能的影响
图4和图5别离是电池选用不同浓度H2O2和NaBH4时 电池的功能曲线,试验中温度固定在60℃,阳极流速0.8 mL/min,阴极流速为 3.2 mL/min。从图4中能够看出当阳极浓 度固定为10%NaBH4时,跟着阴极H2O2的浓度添加,电池的开路电压及比功率均有大幅进步。阴极 H2O2的浓度为5%时, 电池的开路电压仅为1.35 V,最大比功率为88 mW/cm2;当阴 极改为10%的H2O2时,电池开路电压升高为 1.45 V,最大比 功率添加到96 mW/cm2;持续添加阴极H2O2的浓度至20% 时,电池的开路电压升高至1.52 V,最大比功率超越了 130 mW/cm2。图5为固定阴极H2O2的浓度为10%时,改动阳极 NaBH4的浓度,当阳极浓度由5%升高至10%时,电池的开路 电压和最大比功率别离进步了5 mV和9 mW;当NaBH4的 浓度升高至20%时,电池的开路电压升高至1.45 V,但是其最 大比功率下降至 80 mW/cm2,而且电池在高电流密度下的放 电显着下降,200 mA/cm2放电时电池电压下降至0.2 V,而利 用5%和10%的NaBH4 时该值别离为0.455 V和0.502 V。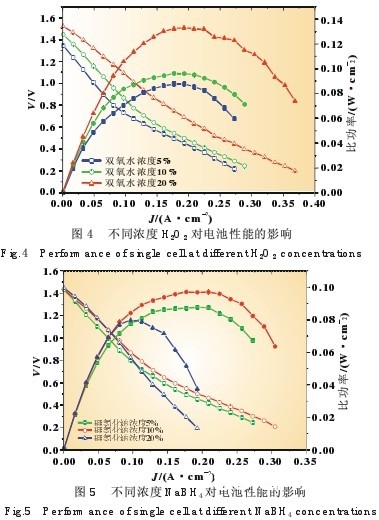
从上面的数据能够看出当阳极浓度固守时,跟着阴极 H2O2浓度的添加,阴极的传质速率加速,然后使反响速率加 快,然后电池的开路电压和最大比功率进步;当阴极浓度固定 时,阳极NaBH4的浓度添加,一方面会进步阳极的传质速率, 但一起也会增大浓差极化和NaBH4的水解,导致阳极的 NaBH4 浸透较多然后添加了阴极极化,因而会呈现试验中浓 度超越某一值时的电池功能下降的现象[16]。
2.4不同Nafion膜关于直接硼氢化钠燃料电池性 能的影响
图6是在相同的作业条件下(60℃;阳极NaBH4浓度为 10%,流速0.8 mL/min;阴极H2O2浓度为10%,流速3.2 mL/min)别离用Nafion112(厚度50μm)和Nafion117(厚度 175μm)制造的电池功能比较。从图中能够看出,跟着Nafion膜厚度的添加,电池的开路电压升高,这首要是因为低电流密 度下NaBH4浸透对电池功能起首要效果,跟着膜厚度的添加 NaBH4浸透逐步削减,阴极极化削减,然后使阴极电极电位升 高,导致电池开路电压升高。但是跟着放电电流密度的添加, NaBH4浸透发作的阴极极化不复兴首要效果,而Nafion膜本 身的膜电导成为操控电池功能的首要因素,Nafion膜越薄则 膜电阻也越小,然后电池功能越好。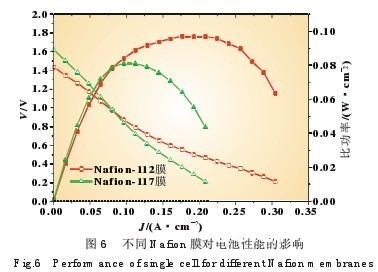
2.5稳定性试验
关于运用Nafion112膜制造的电池还进行耐久性试验, 放电条件是别离在50、100、150 mA/cm2的电流密度下放电 30 min,得到的放电曲线如图7所示。能够看出,整个电池在 短期试验中是有部分时刻不稳定的,而且在不同电流密度放 电的状况下不稳定的状况都有发作,因而这种现象是与放电 无关的,而是电池本身的原因。剖析现象或许是因为阳极 NaBH4水解发作氢气或阴极H2O2分化发作氧气形成,因为放 电的电子负载记载时刻距离为1 s,有或许在很短的时刻内生 成的气体将反响的液体距离而形成瞬时电阻增大导致功能的 瞬间衰减,不过电池电压会很快康复到本来的功能。
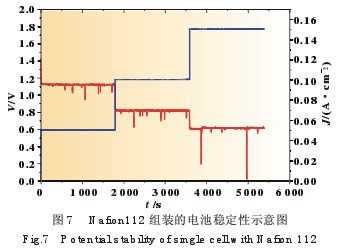
所以说,在直接硼氢化钠燃料电池研讨过程中,怎么找到 使阳极发作8电子转化反响、削减NaBH4水解发作氢气的阳 极催化剂,而且研制能够催化复原 H2O2但不使其分化的阴极 催化剂是下一步研讨的重要方向。
图8为运用Nafion112制造的电池在60℃下相同浓度 (阳极NaBH4:10%,阴极H2O2:10%)、流速(阳极 NaBH4: 0.8 mL/min,阴极H2O2:3.2 mL/min)下几回不同试验的比照,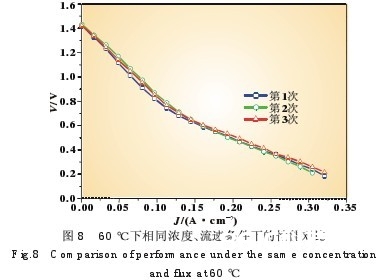
时刻的前后距离约为一个星期。从中能够看出,电池的功能基 本重复没有显着衰减。
图9为通过测验后的膜电极集合体截面的SEM图。能够 显着看出通过测验后的MEA的三相反响界面依然坚持完 整,Nafion膜和催化层粘结可靠并未呈现剥离现象。
3定论
本文选用Nafion112成功地拼装了直接硼氢化钠/双氧 水燃料电池,要点调查查了作业温度、燃料浓度、流速等操作 条件对电池功能的影响;而且比较了不同厚度Nafion膜拼装 的电池功能。试验结果表明:电池的开路电压随温度的升高而 升高;阳极流速和浓度对电池的开路电压影响不大,当流速超 过某一特定值时电池的功能开端下降,当阳极NaBH4浓度过 高时,会使电池的最大比功率和开路电压大为下降,这首要是 因为高浓度NaBH4浸透和水解形成的;电池的开路电压及最 大比功率均随阴极的流速及浓度的进步而增大。关于不同 Nafion膜组成的电池,能够看出Nafion117比 Nafion112开路 电压高,而高电流密度放电下Nafion112功能较好,这说明膜 电导和NaBH4浸透一起影响电池的功能;短期的恒电流放电 和SEM结果表明电池的稳定性比较抱负。
参考文献:
[1]刘建国,衣宝廉,魏昭彬.直接甲醇燃料电池的原理、发展和首要技 术问题[J].电源技能,2001,25(5):363-366.
[2]DOO H J,CHANG H L,CHANG H K,et
al.Performance of a direct
methanol polymer electrolyte
fuel cell[J].J Power Sources,
1998,71(1/2):169-173.
[3]PONCE DE LEON C,WALCH F C,
PLETCHER D,et al.Direct
borohydride fuel cells[J].J
Power Sources,2006,155(2):172-181.
[4]JUNG H W.A comparison of sodium
borohydride as a fuel for
proton exchange membrane fuel
cells and for direct borohydride fuel
cell[J].J Power Sources,2006,155(2):329-339.
[5]LI Z P,LIU B H,ARAI K,et al.
Development of the direct borohy-
dride fuel cell[J].J Alloys and
Compounds,2005,404-406:648-652.
[6]UMIT B DEMIRC I.Direct borohydride
fuel cell:Main issues met
by the membrane-electrodes-assembly
and potenTIal soluTIons[J].J
Power Sources,2007,172(2):676-687.
[7]GEORGE H M,NIE L,JOSEPH M,et
al.Direct NaBH4/H2O2 fuel
cells[J].J Power Sources,
2007,165(2):509-516.
[8]CHOUDHURY N A,RAMAN R K,
SAMPATH S,et al.An alka-
line direct borohydride fuel
cell with hydrogen peroxide as
oxidant [J].J Power Sources,2005,143(1/2):1-8.
[9]ATWAN M H,NORTHWOOD D O,GYENGE
E.EvaluaTIon of colloidal Os
and Os-alloys(Os-Sn,Os-Mo and Os-V)for
electro- catalysis of methanol and
borohydride oxidaTIon[J].Int J Hydrogen
Energy,2005,30(12):1323-1331.
[10]ATWAN M H,MACDONALD C L B
,NORTHWOOD D O,et al. Colloidal
Au and Au-alloy catalysts for direct
borohydride fuelcells:Electrocatalysis
and fuel cell performance[J].J Power
Sources,2006,158(1):36-44.
[11]GYENGE E,ATWAN M H,NORTHWOOD
D O.Electrocatalysis of borohydride
oxidation on colloidal Pt and Pt-alloys
(Pt-Ir,Pt-Ni, and Pt-Au)and application
for direct borohydride fuel cell anodes
[J].J Electrochem Soc,2006,153(1):A 150-A 158.
[12]CHATENET M,MICOUD F,ROCHE I,
et al.Kinetics of sodium borohydride
direct oxidation and oxygen reduction
in sodium hy- droxide electrolyte-Part
I.BH4-electro-oxidation on Au and Ag
catalysts[J].Electrochim Acta,
2006,51(25):5459-5467.
[13]FENG R X,DONG H,WANG Y D,et
al.A simple and high effi-
cient direct borohydride fuel
cell with MnO2-catalyzed cathode[J].
Electrochem Commun,2005,7(4):449-452.
[14]LAKEMAN J B,ROSE A,POINTON
K D,et al.The direct boro-
hydride fuel cell for UUV
propulsion power[J].J Power Sources,
2006,162(2):765-772.
[15]RAMAN R K,PRASHANT S K,SHUKLA
A K.A 28-W portable direct borohydride
hydrogen peroxide fuel-cell stack[J].
J Power Sources,2006,162(2):1073-1076.
[16]CHENG H,SCOTT K.Influence of
operation conditions on direct
borohydride fuel cell performance[J].
J Power Sources,2006,160 (1):407-412.