原电池正负极的确认
原电池正负极的确认 将铜锌两种金属放在电解质溶液中,用导线衔接,便构成原电池的南北极,如图.因为Cu、Zn两种金属电势凹凸不同,所以存在着电势差.电子总是从低电势的极流向高电势的极.电势的凹凸一般可根据金属的生动性确认:金属越生动其电极电势就越低,金属越不生动其电极电势就越高.因为锌比铜生动,所以电子总是从锌极流向铜极.电化学上把 电子流出的极定为负极,流入的极定为正极 .如图所示,锌为负极,铜为正极.
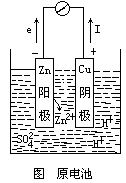
以上介绍了铜-锌原电池,咱们也能够使用相同的原理,把其他的氧化复原反响规划成各种不同的电池。在这些电池中,一般都用复原性较强的物质作为负极,负极向外电路供给电子;用氧化性较强的物质作为正极,正极从外电路得到电子;在电池内部,南北极之间填充电解液。放电时,负极上的电子经过导线流向用电器,从正极流回电池,构成电流。
电极反响
锌片 Zn – 2e – = Zn 2+ (氧化反响)
铜片 2H + + 2e – = H2↑(复原反响)
电池的科学
电池由两个电极和电极之间的电解质构成,因此电化学的研讨内容应包含两个方面:一是电解质的研讨,即电解质学,其间包含电解质的导电性质、离子的传输性质、参加反响离子的平衡性质等,其间电解质溶液的物理化学研讨常称作电解质溶液理论;另一方面是电极的研讨,即电极学,其间包含电极的平衡性质和通电后的极化性质,也便是电极和电解质界面上的电化学行为。电解质学和电极学的研讨都会涉及到化学热力学、化学动力学和物质结构。
使用化学反响发作电能的设备,也称为化学电池 ;但不是一切的电池都归于此类化学电池。
构成原电池的条件 电极资料 : 是由活性物质与导电极板所构成,所谓活性物质是指在电极上可进行氧化复原的物质。两电极资料活性不同,在负极上发作氧化反响;正极上发作复原反响。 电解液 : 含电解质的溶液。 构成回路









