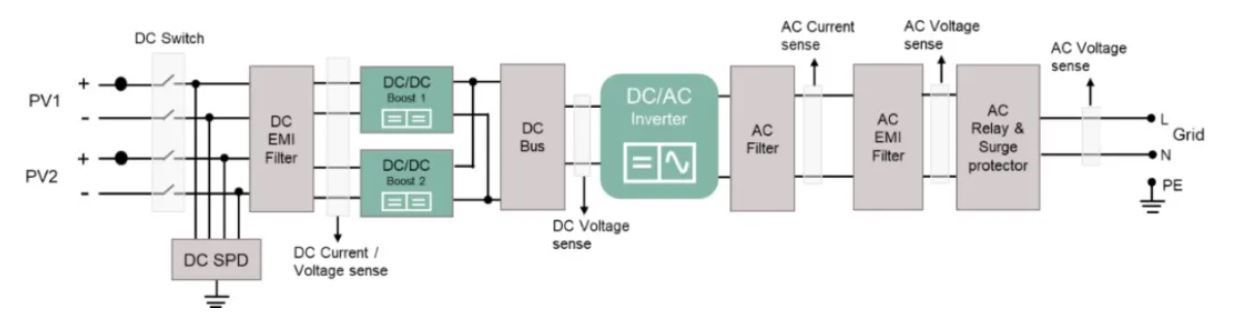
金属锂(Li)的简介
元素符号:Li。银白色的金属。密度0.534克/厘米3。熔点180.54℃。沸点1317℃。是最轻的金属。可与很多无机试剂和有机试剂发作反响。与水的反响十分剧烈。在500℃左右容易与氢发作反响,是仅有能生成安稳得足以熔融而不分化的氢化物的碱金属,电离能5.392电子伏特,与氧、氮、硫等均能化合,是仅有的与氮在室温下反响,生成氮化锂(Li3N)的碱金属。因为易受氧化而变暗,且密度比火油小,故应存放于液体白腊中。
锂声称“稀有金属”,其实它在地壳中的含量不算“稀有”,地壳中约有0.0065%的锂,其丰度居第二十七位。已知含锂的矿藏有150多种,其间首要有锂辉石、锂云母、透锂长石等。海水中锂的含量不算少,总储量达2600亿吨,惋惜浓度太小,提炼真实困难。某些矿泉水和植物机体里,含有丰厚的锂。如有些赤色、黄色的海藻和烟草中,往往含有较多的锂化合物,可供开发使用。我国的锂矿资源丰厚,以现在我国的锂盐产值核算,仅江西云母锂矿就可供挖掘上百年。
元素在太阳中的含量 (ppm)
0.00006
原子体积 (立方厘米/摩尔)
13.10
元素在海水中的含量:
0.17
地壳中含量(ppm)
20
关于锂元素的首要物理数据:
—————————————————————————————————————————
General(概述):
Name(称号): Lithium Symbol:(符号): Li
Group(组,族): Alkali Met(碱金属). Atomic weight:(原子量): 6.94
Density @ 293 K(密度@293K): 0.53 g/cm3 Atomic volume(原子体积): 13.10 cm3/mol
Group: Alkali Met. discovered(发现日期): 1817
States(态):
state (s, l, g): s
melTIng point(熔点): 453.74 K boiling point(沸点): 1620 K
Heat of fusion(熔解热): 3.00 kJ/mol Heat of vaporizaTIon(汽化热): 145.920 kJ/mol
Energies(能量):
1st ionizaTIon energy(第1电离能): 520.2 kJ/mole
electronegaTIvity(电负性): 0.98 2nd ionization energy(第2电离能): 7394.4 kJ/mole
electron affinity(电子亲和能): 59.63 kJ/mole 3rd ionization energy(第3电离能):: 11814.6 kJ/mole
Specific heat(比热): 3.6 J/gK heat atomization(原子化热): 161 kJ/mole atoms
Oxidation & Electrons(氧化&电子):
Shells(壳): 2,1 electron configuration(电子构型): [He] 2s1
minimum oxidation number(最小氧化数): -1 maximum oxidation number(最大氧化数): 1
min. common oxidation no(常见最低氧化数): 0 max. common oxidation no(常见最大氧化数): 1
Appearance & Characteristics(外观&特征):
structure(结构): bcc: body-centered cubic (体心立方) color:(色泽) silvery (银白色)
uses(用处): batteries, lubricant (电池,光滑油) toxicity(毒性):
hardness(硬度): 0.6 mohs (06 莫氏硬度) characteristics(特征): soft, lightest solid
Reactions(反响):
reaction with air(与空气的反响): vigorous(生动), =>Li2O
reaction with 6M HCl(与6M的HCl反响): vigorous(生动), =>H2, LiCl reaction with 6M HCl(与6M的HCl反响): vigorous(生动), =>H2, LiCl
reaction with 15M HNO3:(与15M的HNO3反响): vigorous(生动), =>LiNO3 reaction with 6M NaOH(与6M的NaOH反响): mild(温文), =>H2, LiOH
Other Forms(其它方式):
number of isotopes(同位素数): 2 hydride(s)(氢化物): LiH
oxide(s)(氧化物): Li2O chloride(s)(氯化物): LiCl
Radius(半径):
ionic radius (2- ion)(离子半径 2-离子): pm ionic radius (1- ion)(离子半径 1-离子) : pm
atomic radius(原子半径): 152 pm ionic radius (1+ ion)(离子半径1+离子): 90 pm
ionic radius (2+ ion))(离子半径2+离子) : pm ionic radius (3+ ion))(离子半径3+离子): pm
Conductivity(传导性):
thermal conductivity(导热性): 84.8 J/m-sec-deg
electrical conductivity(导电性): 107.8 1/mohm-cm polarizability(极化): 24.3 A^3
Abundance(富余):
source(来历): Spodumene (silicate)( 锂辉石,硅化物)
rel. abund. solar system: 1.757 log abundance earth’s crust: 1.3 log
cost, pure: 27 $/100g cost, bulk: $/100g
锂是继钾和钠后发现的又一碱金元素。发现它的是瑞典化学家贝齐里乌斯的学生阿尔费特森。1817年,他在剖析透锂长石时,终究发现一种新金属,贝齐里乌斯将这一新金属命名为lithium,元素符号定为Li。该词来自希腊文lithos(石头)。
锂发现的第二年,得到法国化学家伏克兰从头剖析必定。
锂在地壳中的含量比钾和钠少的多,它的化合物不多见,是它比钾和钠发现的晚的必定要素。
锂,原子序数3,原子量6.941,是最轻的碱金属元素。元素名来历于希腊文,本意是“石头”。1817年由瑞典科学家阿弗韦聪在剖析透锂长石矿时发现。自然界中首要的锂矿藏为锂辉石、锂云母、透锂长石和磷铝石等。在人和动物机体、土壤和矿泉水、可可粉、烟叶、海藻中都能找到锂。天然锂有两种同位素:锂6和锂7。
金属锂为一种银白色的轻金属;熔点为180.54°C,沸点1342°C,密度0.534克/厘米³,硬度0.6。金属锂可溶于液氨。
锂与其它碱金属不同,在室温下与水反响比较慢,但能与氮气反响生成黑色的一氮化三锂晶体。锂的弱酸盐都难溶于水。在碱金属氯化物中,只需氯化锂易溶于有机溶剂。锂的挥发性盐的火焰呈深赤色,可用此来判定锂。
锂很容易与氧、氮、硫等化合,在冶金工业中可用做脱氧剂。锂也能够做铅基合金和铍、镁、铝等轻质合金的成分。锂在原子能工业中有重要用处。
将质量数为6的同位素(6Li)放于原子反响堆中,用中子照耀,能够得到氚。氚能用来进行热核反响,有着重要的用处。锂首要以硬脂酸锂的方式用作光滑脂的增稠剂。这种光滑剂兼有高抗水性、耐高温文杰出的低温功能。锂化物用于陶瓷制品中,以起到助溶剂的效果。在冶金工业中也用来作脱氧剂或脱氯剂,以及铅基轴承合金。锂也是铍、镁、铝轻质合金的重要成分。
一、锂的存在、发现和制取

锂在地壳中约含0.0065%,其丰度居第27位。在海水中大约2600亿吨锂,人和动物体内也有很少的锂存在。体重70公斤的正常人体中,锂的含量为2.2毫克。现在自然界已发现含锂矿石达150多种。锂在自然界中存在的首要方式为锂辉石(LiAlSi2O6),锂云母[Li2(F,OH)2Al(SiO3)3]等,我国江西有丰厚的锂云母矿。
锂是在1817年被闻名化学家贝齐里乌斯的学生阿尔费特逊在剖析一种矿石的成分时发现的,贝齐里乌斯将其命名为锂。到1855的年本生和马奇森选用电解熔化氯化锂的办法才制得它,工业化制锂是在1893年由根莎提出的,锂从被认定是一种元素到工业化制取前后历时76年。现在电解LiCl制取锂,仍要耗费很多的电能,每炼一吨锂就耗电高达六、七万度。
锂归于效果没有确认的元素,但Li+存在于人体安排的体液中,首要影响中枢神经系统。锂不但是既轻又软、比热最大的金属,并且仍是在一般温度下呈固体状况的一般资料中最轻的一种,一般储藏于火油或液体白腊中。纯锂的比重跟枯燥的木材差不多,等于一般称作轻金属的铝的密度的五分之一,简直只需同体积水的分量的一半。即便把锂放到汽油中,它也会象软木塞相同轻轻地浮起来。在室温条件下,锂能和空气中的氮气和氧气发作激烈的化学反响。因为锂具有和氢、氧、氮、碳及氧化物、硅酸盐等物质结合的才能,冶金工业部分把锂作为“捕气剂”、“脱流剂”,能够消除金属铸件中的孔隙气泡、杂质和其他缺点。
荧光屏是把荧光物质涂在玻璃上制成的。不过这不是一般的玻璃,而是加进了锂的锂玻璃。在玻璃中加进锂或锂的化合物,能够进步玻璃的强度和耐性。
把含锂的陶瓷涂到钢铁或铝、镁等金属的外表,构成一层薄而轻、亮光而耐热的涂层,可作喷气发起机焚烧室和火箭、导弹外壳的保护层。锂与铝、镁、铍等“协作”组成合金,既轻又韧,已被很多用于导弹、火箭、飞机等制作上。
光滑剂中加进锂的化合物,能够大大改进光滑效能。此种光滑剂适用于温度在—50℃至200℃的规模,因而被广泛使用于航空、动力等部分的各种机械设备和仪器仪表。
某些锂的有机化合物,如硬脂酸锂、软脂酸锂等,它们的物理功能不随环境温度改动而改动,因而是二种安全可靠的光滑剂,并具有“永久性”效果。假如在轿车的一些零件上加一次锂光滑剂,就足以用到轿车作废停止。
氢化锂遇水发作激烈的化学反响,发作很多的氢气。两公斤氢化锂分化后,能够放出氢气566千升。氢化锂的确是名不虚传的“制作氢气的工厂”。第二次世界大战期间,美国飞行员备有简便的氢气源——氢化锂丸作应急之用。飞机失事坠落在水面时,只需一碰到水,氢化锂就当即与水发作反响,开释出很多的氢气,使救生设备(救生艇、救生衣、信号气球等)充气胀大。
碱性蓄电池组的电解溶液里有氢氧化钠溶液,现在参加几克氢氧化锂溶液,蓄电池的使用寿命能够添加两倍,作业温度规模可加大到-20℃—-40℃。
锂——氯、锂——硒之类的电池,已在手机、笔记本电脑以及某些国防军事部分中得到使用。用锂电池发电来开动轿车,行车费用只需一般汽油发起机轿车的三分之一。锂高能电池是一种很有出路的动力电池。它分量轻,贮电才能大,充电速度快,适用规模广,出产本钱低,作业时不会发作有害气体,不至于形成大气污染。由锂制取氚,用来发起原子电池组,中心不需充电,可接连作业20年。
氢弹里装的不是一般的氢,而是比一般氢简直要重一倍的重氢或重二倍的超重氢。用锂能够出产出超重氢——氚,还能制作氢化锂、氘化锂、氚化锂。前期的氢弹都用氘和氚的混和物作“炸药”,当今的氢弹里的“爆破物”多数是锂和氘的化合物——氘化锂。我国1967年6月l7日成功地爆破的第一颗氢弹,其间的“炸药”便是氢化锂和氘化锂。1公斤氘化锂的爆破力适当于5万吨烈性梯恩梯炸药。据估计,l公斤铀的能量若都开释出来能够使一列火车运转4万公里; l公斤氘和氚的混和物却能够使一列火车从地球开到月球;而I公斤锂经过热核反响放出的能量,适当于焚烧20000多吨优质煤,比1公斤铀经过裂变发作的原子能人10倍。
锂的性质及用处
锂具有高的比热和电导率,它的密度是0.53克/厘米3,是自然界中最轻的金属元素。它是十分生动的碱金属元素,常温下它是仅有能与氮气反响的碱金属元素.自然界存在的锂由两种安稳的同位素63Li和73Li组成。锂只能存放在凡土林或白腊中。
锂在发现后一段适当长的时间里,一向遭到萧瑟,仅仅在玻璃、陶瓷和光滑剂等部分,使用了为数不多的锂的化合物。
锂新近的首要工业用处是以硬脂酸理的方式用作光滑剂的增稠剂,锂基光滑脂兼有高抗水性,耐高温文杰出的低温功能。假如在轿车的一些零件上加一次锤光滑剂,就足以用到轿车作废停止。
在冶金工业上,使用锂能激烈地和O、N、Cl、S等物质反响的性质,充任脱氧剂和脱硫剂。在铜的锻炼过程中,参加十万分之一到万分之一的锂,能改进铜的内部结构,使之变得愈加细密,然后进步铜的导电性。锂在铸造优质铜铸件中能除掉有害的杂质和气体。在现代需求的优质特别合金钢材中,锂是铲除杂质最理想的资料。
1kg锂焚烧后可开释42998kJ的热量,因而理是用来作为火箭燃料的最佳金属之一。1kg锂经过热核反响放出的能量适当于二万多吨优质煤的焚烧。若用锂或锂的化合物制成固体燃料来替代固体推进剂,用作火箭、导弹、宇宙飞船的推动力,不只能量高、燃速大,并且有极高的比冲量,火箭的有效载荷直接取决于比冲量的巨细。
假如在玻璃制作中参加锂,锂玻璃的溶解性仅仅一般玻璃的1/100(每一一般玻璃杯热茶中大约有万分之一克玻璃),参加锂后使玻璃成为“永不溶解”,并能够抗酸腐蚀。
纯铝太软,当在铝中参加少数的Li、Mg、Be等金属熔成合金,既简便,又特别坚固,用这种合金来制作飞机,能使飞机减轻2/3的分量,一架锂飞机两个人就能够抬走。Li-Pb合金是一种杰出的减摩资料。
真正使锂成为引人注意图金属,仍是在它的优异的核功能被发现之后。因为它在原子能工业上的共同功能,人们称它为“高能金属”。
6Li捕捉低速中子才能很强,能够用来操控铀反响堆中核反响发作的速度,一起还能够在防辐射和延伸核导弹的使用寿命方面及将来在核动力飞机和宇宙飞船中得到使用。6Li在原子核反响堆顶用中子照耀后能够得到氚,而氚可用来完成热核反响。
6Li在核设备中可用作冷却剂。
锂电池是本世纪三、四十年代才研制开发的优质动力,它以开路电压高,比能量高,作业温度规模宽,放电平衡,自放电子等长处,已被广泛使用于各种范畴,是很有出路的动力电池。用锂电池发电来开动轿车,行车费只需一般汽油发起机车的1/3。由锂制取氚,用来发起原子电池组,中心不需求充电,可接连作业20年。现在,要处理轿车的用油危机和排气污染,重要途径之一便是开展向锂电池这样的新式电池。
三、锂的化合物用处
锂化物新近的重要用处之一是用于陶瓷制品中,特别是用于搪瓷制品中,锂化合物的首要效果是作助熔剂。
LiF对紫外线有极高的透明度,用它制作的玻璃能够洞悉荫蔽在银河系最深处的奥妙。锂玻璃可用来制作电视机显像管。
二战期间,美国飞行员备有简便应急的氢气源—氢化锂丸。当飞机失事坠落在水面时,只需一碰到水,氢化锂就当即溶解开释出很多的氢气,使救生设备充气胀大.
当狼吃下含有锂化合物的肉食后,能引起消化不良,胃口大减,然后改动狼食肉的习性,这种习性还具有遗传性。
锂盐可治疗癫狂病,己在临床上得到使用。动脉硬化性心脏病的发病率,与该区域饮食中锂的含量成反比。北京积水潭医院使用锂制剂治疗急性痢疾,效果近90%。北京同仁医院选用锂制剂,治疗再生障碍性贫血也有必定的效果。
用氘化锂和氮化锂来替代氘和氚装在氢弹里充任炸药,到达氢弹爆破的意图。我国于1967年6月17日成功爆破的第一颗氢弹里便是使用氘化锂。
LiBH4和LiAlH4,在有机化学反响中被广泛用做复原剂,LiBH4能复原醛类、酮类和酯类等。LiAlH4,是制备药物、香料和精密有机化学药品等中重要的复原剂。LiAlH4,也可用作喷气燃料。LiAlH4是对杂乱分子的特别键合的强复原剂,这种试剂已成为许多有机组成的重要试剂。
有机锂化合物与有机酸反响,得到能水解成酮的加成产品,这种反响被用于维生素A组成的一步。有机锂化物加成到醛和酮上,得到水解时能发作醇的加成产品。
由锂和氨反响制得的氨基锂被用来引进氨基,也被用作脱卤试剂和催化剂。
人类对金属锂的使用现在已有了杰出的初步,但因为锂的出产工艺比较杂乱,本钱很高。假如人们一旦处理了这些问题,锂的优良功能将得到进一步的发挥,然后扩展它的使用规模。
锂,原子序数3,原子量6.941,是最轻的碱金属元素。元素名来历于希腊文,本意是“石头”。1817年由瑞典科学家阿弗韦聪在剖析透锂长石矿时发现。自然界中首要的锂矿藏为锂辉石、锂云母、透锂长石和磷铝石等。在人和动物机体、土壤和矿泉水、可可粉、烟叶、海藻中都能找到锂。天然锂有两种同位素:锂6和锂7。
金属锂为一种银白色的轻金属;熔点为180.54°C,沸点1342°C,密度0.534克/厘米³,硬度0.6。金属锂可溶于液氨。
锂与其它碱金属不同,在室温下与水反响比较慢,但能与氮气反响生成黑色的一氮化三锂晶体。锂的弱酸盐都难溶于水。在碱金属氯化物中,只需氯化锂易溶于有机溶剂。锂的挥发性盐的火焰呈深赤色,可用此来判定锂。
锂很容易与氧、氮、硫等化合,在冶金工业中可用做脱氧剂。锂也能够做铅基合金和铍、镁、铝等轻质合金的成分。锂在原子能工业中有重要用处。