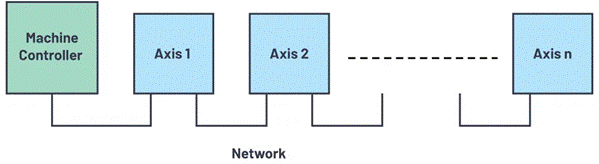
电池的作业原理
电池运用进程电池放电进程,电池放电时在负极上进行氧化反响,向外供给电子,在正极上进行复原反响,从外电路承受电子,电流经外电路而从正极流向负极,电解质是离子导体,离子在电池内部的正负极之间的定向移动而导电,阳离子流向正极,阴离子流向负极。电池放电的负极为阳极,放电的正极为阴极,在阳极两类导体界面上发作氧化反响,在阴极的两类导体界面上发作复原反响。整个电池形成了一个由外电路的电子系统和电解质液的离子系统构成的完好放电系统,然后发生电能供电。
在化学电池中,化学能直接转变为电能是靠电池内部自发进行氧化、复原等化学反响的成果,这种反响分别在两个电极
![]() 上进行(见图)。负极活性物质由电位较负并在电解质中安稳的复原剂组成,如锌、镉、铅等生动金属和氢或碳氢化合物等。正极活性物质由电位较正并在电解质中安稳的氧化剂组成,如二氧化锰、二氧化铅、氧化镍等金属氧化物,氧或空气,卤素及其盐类,含氧酸及其盐类等。电解质则是具有杰出离子导电性的资料,如酸、碱、盐的水溶液,有机或无机非水溶液、熔融盐或固体电解质等。当外电路断开时,南北极之间虽然有电位差(开路电压),但没有电流,存储在电池中的化学能并不转化为电能。当外电路闭合时,在两电极电位差的效果下即有电流流过外电路。
上进行(见图)。负极活性物质由电位较负并在电解质中安稳的复原剂组成,如锌、镉、铅等生动金属和氢或碳氢化合物等。正极活性物质由电位较正并在电解质中安稳的氧化剂组成,如二氧化锰、二氧化铅、氧化镍等金属氧化物,氧或空气,卤素及其盐类,含氧酸及其盐类等。电解质则是具有杰出离子导电性的资料,如酸、碱、盐的水溶液,有机或无机非水溶液、熔融盐或固体电解质等。当外电路断开时,南北极之间虽然有电位差(开路电压),但没有电流,存储在电池中的化学能并不转化为电能。当外电路闭合时,在两电极电位差的效果下即有电流流过外电路。
一起在电池内部,因为电解质中不存在自由电子,电荷的传递必定随同南北极活性物质与电解质界面的氧化或复原反响,以及反响物和反响产品的物质搬迁。电荷在电解质中的传递也要由离子的搬迁来完结。因而,电池内部正常的电荷传递和物质传递进程是确保正常输出电能的必要条件。充电时,电池内部的传电和传质进程的方向恰与放电相反;电极反响有必要是可逆的,才干确保反方向传质与传电进程的正常进行。因而,电极反响可逆是构成蓄电池的必要条件。依照热力学原理,在等温等压下,电池系统所能输出的最大功即系统的自由能增量为
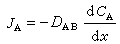
式中E为电池电动势(伏);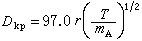 为吉布斯反响自由能增量(焦);F为法拉第常数=96500库=26.8安·小时;n为电池反响的当量数。这是电池电动势与电池反响之间的根本热力学关系式,也是核算电池能量转化功率的根本热力学方程式。实际上,当电流流过电极时,电极电势都要违背热力学平衡的电极电势,这种现象称为极化。电流密度(单位电极面积上经过的电流)越大,极化越严峻。极化现象是形成电池能量丢失的重要原因之一。极化的原因有三:①由电池中各部分电阻形成的极化称为欧姆极化;②由电极-电解质界面层中电荷传递进程的阻滞形成的极化称为活化极化;③由电极-电解质界面层中传质进程缓慢而形成的极化称为浓差极化。减小极化的办法是增大电极反响面积、减小电流密度、进步反响温度以及改进电极外表的催化活性。
为吉布斯反响自由能增量(焦);F为法拉第常数=96500库=26.8安·小时;n为电池反响的当量数。这是电池电动势与电池反响之间的根本热力学关系式,也是核算电池能量转化功率的根本热力学方程式。实际上,当电流流过电极时,电极电势都要违背热力学平衡的电极电势,这种现象称为极化。电流密度(单位电极面积上经过的电流)越大,极化越严峻。极化现象是形成电池能量丢失的重要原因之一。极化的原因有三:①由电池中各部分电阻形成的极化称为欧姆极化;②由电极-电解质界面层中电荷传递进程的阻滞形成的极化称为活化极化;③由电极-电解质界面层中传质进程缓慢而形成的极化称为浓差极化。减小极化的办法是增大电极反响面积、减小电流密度、进步反响温度以及改进电极外表的催化活性。